Uma proteína celular super linda, a septina, mostrou ter mais papeis que a até então conhecida capacidade de ceder suporte estrutural durante a divisão celular. A maioria dos estudos com essa e outras proteínas do tipo que se ligam a GTP tem sido desenvolvida em células de leveduras. Entretanto, um estudo recente da equipe de Pascale Cossart do Instituto Pasteur em Paris, mostrou que, em células humanas, esta proteína tem a capacidade de dar um abraço malevo em patógenos bacterianos, imobilizando-os e assim impedindo que venham a invadir células vizinhas.
O triste fim da Shigella (azul) sob o abraço malevo da septina (vermelho)
Esse padrão satisfatório foi observado sobre células da pobre Shigella, uma bactéria mais conhecida por causar surtos de diarreia, por vezes letais. Após o "enjaulamento" pela septina, a não tão sortuda Shigella (e os outros patógenos que cruzarem o caminho da tenebrosa proteina), recebem o destino infalível da autofagia, virando apenas história.
Não é de surpreender que esse comportamento agora já esteja embasando novas ideias de controles terapêuticos de patógenos, talvez suplementando o sistema imune com drogas que mimetizem o sinalizador que permite a proliferação das jaulas de septina, assim implementando a defesa do organismo.
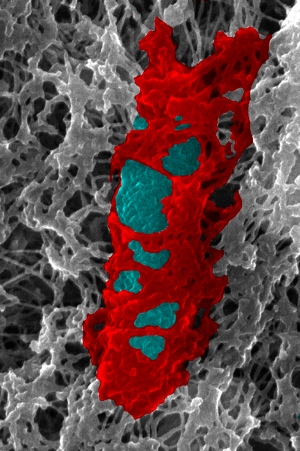
Bem satisfatório esse padrão de aprisionamento molecular!
ResponderExcluirPor um uso mais contínuo da palavra "satisfação" e seus derivados ;)
ResponderExcluir